Radioattività come cronometro per la datazione
- P. Strolin
-
Autore della discussione
- Offline
- Premium Utente
-
Less
Di più
10 Anni 11 Mesi fa - 8 Anni 11 Mesi fa #162
da P. Strolin
Fino dai suoi primordi l’uomo si è distinto per la capacità di sfruttare “strumentalmente” quello che gli offre la Natura. Vediamolo con un antichissimo esempio, esaminando con attenzione quello che possiamo avere distrattamente visto in musei.
Le figure 1a e 1b mostrano degli strumenti “bifacciali” (ossia lavorati su ambedue le facce) in selce scheggiata (detti “ amigdale ” per la loro forma a mandorla) realizzati con grande maestria nel Paleolitico Inferiore (750.00-120.000 anni fa, quindi con inizio precedente al sopravvenire dell’ Homo sapiens ) dalla "industria" della cosiddetta “ Cultura Acheuleana ”. Esse sono tratte da opere del paleoantropologo Gabriel de Mortillet (1821-98).
Centinaia di migliaia di anni dopo, l’evolutissimo Homo sapiens di oggi continua a utilizzare strumentalmente la Natura e i suoi fenomeni.
In quest’articolo considereremo l’utilizzazione della radioattività naturale come “cronometro” per la datazione, prendendo come riferimento la datazione tramite il Carbonio-14. Altri esempi di “radioattività utile” sono presentati tra i Saggi tematici .
Gli articoli Nucleo atomico: fenomenologia , Nucleo atomico: legame e Radioattività e decadimenti nucleari vanno considerati come propedeutici.
Un Nobel alla radioattività utile
Immaginate di partecipare a una ricerca archeologica e di trovare un reperto di grande interesse. Vi ponete immediatamente il problema di situarlo nel tempo. I metodi convenzionali lo collocano nel tempo “relativamente” a fattori esterni: condizioni al contorno del suo ritrovamento (ad esempio secondo i metodi della Stratigrafia ), comparazione stilistica in base alle vostre conoscenze o altro. Emerge chiaramente l’importanza di potere formulare una datazione “assoluta”, cioè di “misurare” l’età di un reperto.
L’invenzione di un metodo di datazione assoluta tramite misure di radioattività fu fatta nel 1947 ad opera Willard Libby, che ebbe il Premio Nobel 1960 per la Chimica:
"for his method to use carbon-14 for age determination in archaeology, geology, geophysics, and other branches of science"
(per il suo metodo basato sul carbonio-14 per la determinazione dell'età in archeologia, geologia, geofisica e altri rami della scienza).
Il metodo è basato sull'uso di un isotopo radioattivo del Carbonio: il Carbonio-14 .
Tra i reperti che furono datati da Libby, vi è un campione del rivestimento in pergamena di uno dei famosi Rotoli del Mar Morto , una preziosissima collezione di circa 1000 manoscritti di epoca biblica trovata tra il 1946 e il 1956 nella caverna di Qumran presso il Mar Morto in Israele. La figura 3a mostra un frammento di uno dei manoscritti (il cosiddetto Documento di Damasco ), la figura 3b alcuni dei rotoli ritrovati mentre erano ancora in situ e la figura 3c una vista dall’esterno della caverna dove è stato trovato il Documento di Damasco, assieme alla maggior parte dei manoscritti.
Dai tempi della sua invenzione, la tecnica della radiodatazione ha avuto vastissima applicazione ed è stata estesa dal Carbonio-14 (largamente presente negli organismi viventi assieme agli isotopi dominanti del Carbonio) a isotopi di altri elementi chimici. Comprendiamone passo dopo passo il funzionamento.
Isotopi del Carbonio
Le “ abbondanze isotopiche naturali ” sono definite come le percentuali in massa di ciascun isotopo riscontrabili in Natura, per ogni dato elemento chimico.
Seppure con minima abbondanza isotopica naturale (dell’ordine di 10 -10 %), esiste in Natura anche l’isotopo instabile Carbonio-14 (Z=6, N= , il cui tempo di dimezzamento (definito in
Radioattività e decadimenti nucleari
) è di circa 5730 anni. L’instabilità deriva dall’eccesso di neutroni rispetto agli isotopi stabili, che viene eliminato tramite il
decadimento beta
-
in Azoto-14 (Z=N=7), come mostrato dalla reazione 2 in figura 4. L'elettrone emesso nel decadimento può essere agevolmente osservato.
, il cui tempo di dimezzamento (definito in
Radioattività e decadimenti nucleari
) è di circa 5730 anni. L’instabilità deriva dall’eccesso di neutroni rispetto agli isotopi stabili, che viene eliminato tramite il
decadimento beta
-
in Azoto-14 (Z=N=7), come mostrato dalla reazione 2 in figura 4. L'elettrone emesso nel decadimento può essere agevolmente osservato.
Abbondanza isotopica naturale del Carbonio-14
Sulla base dello schema mostrato in figura 5, vediamo come in Natura si raggiunge un’abbondanza isotopica del Carbonio-14 in prima approssimazione costante nel tempo.
Il meccanismo di equilibrio dinamico è analogo a quello che regola il livello di un lago a un valore tale che l’immissione di acqua da fiumi e piogge compensa la perdita per evaporazione e per emissione in corsi d'acqua.
Principio del metodo di datazione con il Carbonio-14
Il Carbonio è largamente presente negli organismi viventi, vegetali o animali. La datazione con il Carbonio-14 assume quindi un’importanza particolare. Vediamone il principio continuando a fare riferimento alla figura 5 e limitandoci agli organismi viventi su terra.
Consideriamo per esempio la datazione di un campione di legno. Un albero incorpora Carbonio con rapporti isotopici identici alle abbondanze isotopiche naturali, dato che gli isotopi sono chimicamente indistinguibili. Una volta tagliato, l’albero muore e cessa l’assorbimento di Carbonio. Da quel momento, il contenuto di Carbonio-14 nel legno decresce in funzione del tempo secondo la legge temporale (esponenziale) dettata dal decadimento. Dal “rapporto isotopico” tra il Carbonio-14 e gli isotopi stabili si può quindi risalire al tempo trascorso dal taglio dell’albero, cioè datare il campione di legno.
Per fare l’esempio più banale, da un rapporto isotopico misurato pari alla metà dell’abbondanza isotopica naturale possiamo dedurre che dal taglio dell’albero è trascorso un tempo pari a quello di dimezzamento (5730 anni). Lo si vede anche dalla figura 6, che ora presentiamo.
.............................................................................................................................
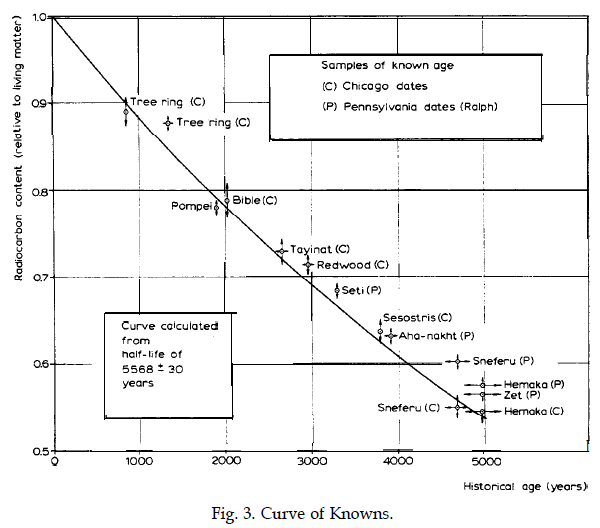
Fig. 6. La “Curva dei Conosciuti”, dalla Lezione Nobel di W. Libby - Immagine Nobelprize.org Nobel media
......................
La storica ed eloquente figura 6 è tratta dalla lezione Nobel di Libby e riporta misure della riduzione frazionaria del Carbonio-14 rispetto all’abbondanza isotopica naturale effettuate su campioni di età nota. L'asse dei tempi giunge sino a 5000 anni orsono, da paragonare ai 5730 anni del tempo di dimezzamento. Le misure sono state effettuate in due laboratori diversi.
Il punto indicato con “Bible” e situato in corrispondenza di 2000 anni si riferisce ai rotoli biblici di Qumran, di cui sopra.
Il paragone con la previsione data dalla legge temporale del decadimento (linea continua) fornisce una verifica della validità del metodo.
In sostanza, il Carbonio-14 fornisce una sorta di “cronometro” (letteralmente "misuratore di tempo", dal greco chrónos, χρόνος: tempo e métron, μέτρον: misura), che scatta al momento in cui cessa l'assorbimento di Carbonio. Non resta che leggerlo con una tecnica adatta.
Ritorneremo sulla figura 5 quando parleremo delle tecniche di "lettura del cronometro" e commenteremo il (basso) valore del conteggio per minuto ottenibile tramite la rivelazione degli elettroni emessi nei decadimenti beta - .
Metodologia pratica per la datazione con il Carbonio-14
L’ipotesi semplificativa dietro il discorso condotto sul principio della datazione con il Carbonio-14 è la costanza della sua concentrazione nell’atmosfera.
Questa ipotesi è vera nella misura in cui è costante il flusso di radiazione cosmica. Non è rigorosamente così: lo dimostra l’osservazione delle variazioni nell’attività del Sole, che è la principale sorgente della radiazione che colpisce la Terra. Il problema è risolto mediante una curva di calibrazione costruita misurando il rapporto isotopico in reperti la cui età possa essere nota in altro modo. Pur se nata con spirito diverso, la figura 6 fornisce un primo esempio di curva di calibrazione.
Una famosa datazione con il Carbonio-14
Una famosa datazione è quella della “ Sacra Sindone ”, per rispondere alla domanda: il tessuto è temporalmente compatibile con l’essere stato sudario di Gesù Cristo? La datazione venne effettuata nel 1988 e indicò una sua origine medioevale, con ovvio seguito di dibattiti e di ipotesi su effetti che possano avere alterato il risultato.
Tecniche di lettura del cronometro
Pur se piccolissimo (come riferimento ricordate il valore dell’abbondanza isotopica naturale), il rapporto isotopico del Carbonio-14 è misurabile con grande sensibilità.
Secondo la tecnica tradizionale, anche la lettura del cronometro è basata sulla radioattività. Parlando in modo rispettoso ma irriverente, la sensibilità proviene dal fatto i nuclei di Carbonio-14 sono pochissimi ma "strillano", cioè emettono elettroni nel decadimento beta - (reazione 2 in figura 4). Il conteggio degli elettroni per unità di tempo mediante un opportuno “rivelatore” permette di determinare il contenuto di Carbonio-14 nel campione, da cui si può risalire al rapporto isotopico e quindi leggere il cronometro.
Un valore tipico del conteggio di elettroni per minuto è fornito nella figura 5 in basso. Noterete subito che esso è molto modesto, in particolare se paragonato al numero totale di nuclei di Carbonio-14 presente nel campione. In un grammo-atomo di Carbonio (12 grammi) è contenuto un numero di atomi di Carbonio-12 pari al Numero di Avogadro N A = 6 x 10 23 . Il numero di atomi di Carbonio-14 in 12 grammi è ottenuto moltiplicandolo per l'abbondanza isotopica (circa 10 -12 ) e risulta valere 6 x 10 11 , ossia 600 miliardi. La quasi totalità dei nuclei di Carbonio-14 non entra nella misura, sta a vedere impassibile e aspetta migliaia di anni prima di decidersi a decadere emettendo un elettrone.
Per rendersene conto quantitativamente, facciamo un conto approssimato della probabilità di decadimento di un singolo nucleo per minuto. Il suo ordine di grandezza è già dato dal rapporto tra 1 minuto e il doppio del tempo di dimezzamento (5730 anni) e risulta essere 10 -10 . Un calcolo completo richiede il ricorso alla legge esponenziale del decadimento di un insieme di nuclei in funzione del tempo (vedete Radioattività e decadimenti nucleari ) e fornisce una probabilità di decadimento di un singolo nucleo per minuto circa eguale 2 x 10 -10 . Il numero di nuclei di Carbonio-14 che decadono nel corso di una misura di ragionevole durata è quindi molto basso e giustifica il basso valore del conteggio di elettroni.
Se però si pensa che quello che si vuole leggere non è altro che il numero "totale" di atomi di Carbonio-14 superstiti dal tempo della morte biologica, sorge spontanea la domanda: ma questi non si possono contare direttamente?
In effetti, in Chimica la determinazione quantitativa degli elementi presenti in un campione può essere fatta tramite la "spettrometria di massa". Potete vederne una descrizione e una rappresentazione schematica sul testo online Chimica: concetti e modelli , citato tra i collegamenti.
Nella spettrometria di massa, gli atomi dei vari elementi chimici sono estratti dal campione, “ionizzati” (cioè privati di almeno un elettrone), accelerati tramite un campo elettrico e quindi immessi in un campo magnetico, che ne deflette le traiettorie. Il punto è che a parità di velocità tanto maggiore è la massa, tanto maggiore è una forma di "rigidità" (in sostanza per inerzia) presentata dalle traiettorie stesse e tanto minore ne è la deflessione. I diversi elementi chimici possono così essere fisicamente separati, in modo da poterne determinare il contenuto nel campione.
Tuttavia, l’ordinaria spettrometria di massa – frequentemente utilizzata dai chimici - non offre la risoluzione necessaria per separare e distinguere il Carbonio-14 dall’Azoto-14 (un suo "isobaro"), presente anch’esso in ogni organismo biologico e in proporzione talmente maggiore da offuscarlo.
Spettrometria di Massa con Acceleratore
Nella seconda metà degli anni ’70 il problema è stato risolto mediante la “ Accelerator Mass Spectrometry ” (AMS, in italiano “Spettrometria di Massa con Acceleratore”). Vi presenteremo nel seguito un’immagine di uno spettrometro di tale tipo.
Tramite un acceleratore elettrostatico di particelle, gli atomi ionizzati provenienti dai campioni da datare vengono accelerati a energie di qualche MeV (milioni di elettronVolt). Il problema della separazione del Carbonio-14 dall’Azoto-14 viene risolto drasticamente, tramite l'eliminazione della presenza di quest'ultimo: gli ioni immessi nell'acceleratore sono negativi (cioè con aggiunta di elettroni, invece di rimozione), sufficientemente stabili per il Carbonio-14 ma non per l’Azoto-14.
Gli ioni sono poi estratti dall’acceleratore e immessi in un campo magnetico per l'analisi spettrometrica. Si ottengono così misure del rapporto isotopico più sensibili e precise di quelle date dalla tecnica di lettura classica, basata sul decadimento beta - . Per approfondimenti, vedete i collegamenti dati in fine articolo.
La maggiore sensibiltà nella lettura del cronometro fornita da questa tecnica permette di estendere l’intervallo di tempo storico accessibile alla datazione di campioni organici tramite il Carbonio-14.
Inoltre essa è applicabile a qualsiasi isotopo di elemento chimico (in campioni organici o inorganici) che possa essere accelerato e separato, secondo le caratteristiche dello spettrometro disponibile.
Spettrometria di Massa con Acceleratore e sicurezza nucleare
Pur se fuori dal tema datazione, è interessante citare l’applicazione della Spettrometria di Massa con Acceleratore a problemi di sicurezza nucleare.
Come detto in Fissione nucleare: fenomeno fisico e energia , l’impiego di Uranio come combustibile in reattori nucleari richiede che l’Uranio naturale sia “arricchito” in Uranio-235. Questo processo lascia un residuo, detto Uranio “impoverito”, può essere utilizzato per altre applicazioni.
Ma è necessario assicurarsi che l’Uranio impoverito non provenga dal riprocessamento di combustibile nucleare già usato in un reattore, nel qual caso esso costituisce un pericoloso veicolo di prodotti di fissione. Lo può denunciare un alto contenuto di Uranio-236, che la Spettrometria di Massa con Acceleratore è in grado di evidenziare.
Un altro esempio riguarda la misura dei rapporti isotopici del Plutonio presente nell’ambiente, per il monitoraggio del rispetto dei trattati internazionali contro la proliferazione nucleare.
Intervallo temporale accessibile alla datazione
Il tempo trascorso può essere determinato purché non sia né troppo breve né troppo lungo rispetto al tempo di dimezzamento del radioisotopo. Infatti, nel primo caso la sua riduzione sarebbe troppo piccola per essere valutata, nel secondo caso sarebbe il numero di nuclei residui ad essere troppo piccolo per essere misurato con un’incertezza accettabile. Per la datazione di campioni organici con il Carbonio-14 (5730 anni), con le tecniche attuali si può coprire un intervallo di tempo storico approssimativamente tra 100 e 50.000 anni.
Per datazioni al di fuori di quest’intervallo o su campioni di natura diversa (organica o inorganica), è necessario ricorrere ad altri radioisotopi . La Spettrometria di Massa con Acceleratore offre anche il vantaggio di una generale applicabilità.
Cronometro a bomba
Al tempo della “guerra fredda” tra mondo occidentale e impero sovietico, fu condotto un terrificante programma di prove di ordigni nucleari nell’atmosfera, che sostanzialmente durò dagli anni '50 sino ai primi anni ’60. Fu solo con la caduta del “muro di Berlino” (nel 1989), che venne il tempo di un accordo formale per la loro sospensione tramite i cosiddetti Trattati START, menzionati in Fissione nucleare: fenomeno fisico e energia .
Il problema di mantenere la validità della datazione al Carbonio-14 tramite il classico “cronometro a decadimento nucleare” fu risolto facendo ricorso a una opportuna procedura di calibrazione tramite campioni non affetti dalle esplosioni.
Il picco della bomba fece scattare il “cronometro a bomba”, molto più rapido perché regolato dalla diminuzione del Carbonio-14 nell’atmosfera dopo il picco e quindi applicabile su tempi delle decine di anni. L’invenzione della “ datazione con il picco della bomba ” permise, ad esempio, la determinazione dell’anno di nsscita di un individuo tramite la determinazione del Carbonio-14 nello smalto dei denti. Il metodo è stato anche di aiuto in indagini per l’identificazione di cadaveri misteriosi.
In definitiva, quello che avrebbe potuto mettere in crisi una metodologia di misura inventata dagli scienziati sfruttando un fenomeno naturale è stato da loro sfruttato con un’altra invenzione: il cronometro a bomba. Irrefrenenabili nell’inventare!
...
Fig. 9. Willard Libby e il suo apparato per la datazione
Immagine UCLA History
...
Fig. 10. Lo Spettrometro di Massa con Acceleratore del Laboratorio LABEC a Firenze
Immagine M. Fedi – INFN/Firenze
Conclusione
La figura 9 mostra Willard Libby e il suo pionieristico apparato sperimentale, Oggi, la figura 10 ritrae uno Spettrometro di Massa con Acceleratore, quello del Laboratorio LABEC dell’INFN a Firenze. Un altro esempio è fornito dallo Spettrometro di Massa con Acceleratore del Laboratorio CIRCE a Caserta. La crescita di scala è impressionante, e corrisponde a un enorme progresso nella qualità delle misure e nel dominio di applicabilità della datazione.
Infatti, come si è detto, ora il Carbonio-14 permette datazioni in un intervallo di tempo storico tra 100 e 50.000 anni, molto più esteso di quello mostrato nella Curva dei Conosciuti in figura 6. Inoltre l'impiego di altri radioisotopi ha esteso la possibilità di datazione a campioni di natura diversa – anche inorganici, come rocce – e alle diverse scale di tempo permesse dal loro tempo di dimezzamento.
Fig. 11. Tramonto invernale all’ombra della quercia - Immagine Massimo su Nikonclub
Come quella della radiodatazione, importanti invenzioni possono nascere con apparecchiature modeste e portare poi a grandi sviluppi. E anche la grande quercia in figura 11 è cresciuta da un piccolo seme.
Collegamenti
G. Valitutti, M. Falasca, A. Tifi e A. Gentile, Chimica: concetti e modelli, ll numero di massa e gli isotopi , Ebook Zanichelli Scuola
Pier Andrea Mandò, Fisica nucleare per l’Arte e l’Archeologia , Asimmetrie/INFN 9 (2009) e Seminario
Mariaelena Fedi, La datazione al radiocarbonio per mezzo della Spettrometria di Massa con Acceleratore (2009)
Beta Analytic, Datazione al radiocarbonio con spettrometria di massa con acceleratore e Introduction to Radiocarbon Determination by the Accelerator Mass Spectrometry Method
.
Professore Emerito di Fisica Sperimentale
Università di Napoli "Federico II"
Complesso Univ. Monte S. Angelo
Via Cintia - 80126 Napoli - Italy
Radioattività come cronometro per la datazione è stato creato da P. Strolin
Radioattività come cronometro per la datazione
..........
................
Per domande: autori o
Domanda a un esperto
................Fino dai suoi primordi l’uomo si è distinto per la capacità di sfruttare “strumentalmente” quello che gli offre la Natura. Vediamolo con un antichissimo esempio, esaminando con attenzione quello che possiamo avere distrattamente visto in musei.
| .............................................
Fig. 1a. Strumenti bifacciali in selce da Chelles (Francia), Paleolitico inferiore Immagine Storia Universale e Leonardo | ... | ......................
Fig. 1b. Strumento bifacciale in selce da Saint-Acheul (Francia), Paleolitico inferiore Da G. De Mortillet, Le préhistorique: origine et antiquité de l’homme[/ur] p. 142 (1883) |
Le figure 1a e 1b mostrano degli strumenti “bifacciali” (ossia lavorati su ambedue le facce) in selce scheggiata (detti “ amigdale ” per la loro forma a mandorla) realizzati con grande maestria nel Paleolitico Inferiore (750.00-120.000 anni fa, quindi con inizio precedente al sopravvenire dell’ Homo sapiens ) dalla "industria" della cosiddetta “ Cultura Acheuleana ”. Esse sono tratte da opere del paleoantropologo Gabriel de Mortillet (1821-98).
| ................................................................................
Fig. 2. Strumento bifacciale: una grande innovazione Da Björn Kurtén, Our earliest ancestors, Columbia Univ. Press (1993) Il primo uomo, Laterza (1998) | ..... | ...................... Va anzitutto notato che questi strumenti “bifacciali” testimoniano una vera e propria rivoluzione tecnologica frutto di cultura intellettuale. Infatti "si riconosce la ricerca deliberata, vale a dire consapevole, di strumenti con una forma predeterminata, che in precedenza esistevano soltanto nella mente dell'autore" ( J.-L. Arsuaga, I primi pensatori, p. 51-52, Feltrinelli, 2001 ). Gli strumenti bifacciali furano una delle grandi innovazioni nella storia unama. Il paleoantropologo Björn Kurtén lo esprime in modo incisivo tramite la vignetta in figura 2, tratta da una delle sue belle e interessanti opere divulgative. Nella vignetta, l'amigdala è ingrandita in dimensioni. Inoltre essi sono opere che oggi chiameremmo di “ design industriale ”, in cui la ricerca di funzionalità (figura 1b) produce bellezza. Continuando la citazione precedente: "… considera un bifacciale una scultura a tutti gli effetti, senza escludere che oltre a essere funzionale (cioè utile) corrispondesse anche a un gusto per la bellezza (a un’estetica)". |
Centinaia di migliaia di anni dopo, l’evolutissimo Homo sapiens di oggi continua a utilizzare strumentalmente la Natura e i suoi fenomeni.
In quest’articolo considereremo l’utilizzazione della radioattività naturale come “cronometro” per la datazione, prendendo come riferimento la datazione tramite il Carbonio-14. Altri esempi di “radioattività utile” sono presentati tra i Saggi tematici .
Gli articoli Nucleo atomico: fenomenologia , Nucleo atomico: legame e Radioattività e decadimenti nucleari vanno considerati come propedeutici.
| .............................................
Fig. 3a. Frammento del Documento di Damasco (circa 150 a.C.) Rotolo trovato nella caverna 4 di Qumran Immagine Wikipedia | ... | .............................................
Fig. 3b. Rotoli in situ nella caverna 4 di Qumran Immagine Antika | ... | ......................
Fig. 3c. Il sito e la caverna 4 di Qumran presso il Mar Morto (Israele) Immagine Wikipedia |
Un Nobel alla radioattività utile
Immaginate di partecipare a una ricerca archeologica e di trovare un reperto di grande interesse. Vi ponete immediatamente il problema di situarlo nel tempo. I metodi convenzionali lo collocano nel tempo “relativamente” a fattori esterni: condizioni al contorno del suo ritrovamento (ad esempio secondo i metodi della Stratigrafia ), comparazione stilistica in base alle vostre conoscenze o altro. Emerge chiaramente l’importanza di potere formulare una datazione “assoluta”, cioè di “misurare” l’età di un reperto.
L’invenzione di un metodo di datazione assoluta tramite misure di radioattività fu fatta nel 1947 ad opera Willard Libby, che ebbe il Premio Nobel 1960 per la Chimica:
"for his method to use carbon-14 for age determination in archaeology, geology, geophysics, and other branches of science"
(per il suo metodo basato sul carbonio-14 per la determinazione dell'età in archeologia, geologia, geofisica e altri rami della scienza).
Il metodo è basato sull'uso di un isotopo radioattivo del Carbonio: il Carbonio-14 .
Tra i reperti che furono datati da Libby, vi è un campione del rivestimento in pergamena di uno dei famosi Rotoli del Mar Morto , una preziosissima collezione di circa 1000 manoscritti di epoca biblica trovata tra il 1946 e il 1956 nella caverna di Qumran presso il Mar Morto in Israele. La figura 3a mostra un frammento di uno dei manoscritti (il cosiddetto Documento di Damasco ), la figura 3b alcuni dei rotoli ritrovati mentre erano ancora in situ e la figura 3c una vista dall’esterno della caverna dove è stato trovato il Documento di Damasco, assieme alla maggior parte dei manoscritti.
Dai tempi della sua invenzione, la tecnica della radiodatazione ha avuto vastissima applicazione ed è stata estesa dal Carbonio-14 (largamente presente negli organismi viventi assieme agli isotopi dominanti del Carbonio) a isotopi di altri elementi chimici. Comprendiamone passo dopo passo il funzionamento.
Isotopi del Carbonio
Le “ abbondanze isotopiche naturali ” sono definite come le percentuali in massa di ciascun isotopo riscontrabili in Natura, per ogni dato elemento chimico.
| .....................................................................................................
Fig. 4. Reazioni nucleari di formazione (1) e decadimento (2) del Carbonio-14 Immagine Wikipedia | ..... | ...................... L’isotopo del Carbonio con abbondanza isotopica naturale largamente dominante (98,9%) è il Carbonio-12. Esso è stabile, contenendo protoni e neutroni in pari numero (Z=N=6). Stabile è anche il Carbonio-13 (Z=6, N=7), con abbondanza isotopica naturale 1,1%. |
Seppure con minima abbondanza isotopica naturale (dell’ordine di 10 -10 %), esiste in Natura anche l’isotopo instabile Carbonio-14 (Z=6, N=
Abbondanza isotopica naturale del Carbonio-14
Sulla base dello schema mostrato in figura 5, vediamo come in Natura si raggiunge un’abbondanza isotopica del Carbonio-14 in prima approssimazione costante nel tempo.
| ..............................................................................................
Fig. 5. Produzione, distribuzione e decadimento del Carbonio-14 Immagine University of Arizona | ..... | ...................... Il Carbonio-14 è costantemente prodotto come effetto secondario delle collisioni di particelle di provenienza extraterrestre (in particolare i cosiddetti " raggi cosmici ") con nuclei atomici negli strati alti dell’atmosfera terrestre. Se volete approfondirne il meccanismo di produzione, considerate che tra le particelle prodotte in queste collisioni vi sono anche neutroni. Lungo il loro percorso, i neutroni urtano dei nuclei e perdono energia ossia (come si suol dire) vengono “rallentati”. Come nel dar luogo alla fissione nucleare (vedete Fissione nucleare: fenomeno fisico e energia , aumenta così la probabilità che essi interagiscano con i nuclei presenti. Nell'atmosfera terrestre, i neutroni rallentati interagiscono con nuclei di Azoto-14 (Z=7, N=7) trasformandoli in nuclei di Carbonio-14 (Z=6, N= Il Carbonio-14 si combina poi con l’Ossigeno formando anidride carbonica. Limitandoci a considerare quanto accade sulla terra, dall’atmosfera esso passa così nei vegetali e da questi negli altri organismi viventi. Il rapporto isotopico tra il Carbonio-14 e gli altri isotopi dell’elemento si stabilizza al valore dell’abbondanza isotopica naturale grazie a un meccanismo di “equilibrio dinamico”, nel quale la sua produzione compensa le perdite per decadimento radioattivo. |
Il meccanismo di equilibrio dinamico è analogo a quello che regola il livello di un lago a un valore tale che l’immissione di acqua da fiumi e piogge compensa la perdita per evaporazione e per emissione in corsi d'acqua.
Principio del metodo di datazione con il Carbonio-14
Il Carbonio è largamente presente negli organismi viventi, vegetali o animali. La datazione con il Carbonio-14 assume quindi un’importanza particolare. Vediamone il principio continuando a fare riferimento alla figura 5 e limitandoci agli organismi viventi su terra.
Consideriamo per esempio la datazione di un campione di legno. Un albero incorpora Carbonio con rapporti isotopici identici alle abbondanze isotopiche naturali, dato che gli isotopi sono chimicamente indistinguibili. Una volta tagliato, l’albero muore e cessa l’assorbimento di Carbonio. Da quel momento, il contenuto di Carbonio-14 nel legno decresce in funzione del tempo secondo la legge temporale (esponenziale) dettata dal decadimento. Dal “rapporto isotopico” tra il Carbonio-14 e gli isotopi stabili si può quindi risalire al tempo trascorso dal taglio dell’albero, cioè datare il campione di legno.
Per fare l’esempio più banale, da un rapporto isotopico misurato pari alla metà dell’abbondanza isotopica naturale possiamo dedurre che dal taglio dell’albero è trascorso un tempo pari a quello di dimezzamento (5730 anni). Lo si vede anche dalla figura 6, che ora presentiamo.
.............................................................................................................................
Fig. 6. La “Curva dei Conosciuti”, dalla Lezione Nobel di W. Libby - Immagine Nobelprize.org Nobel media
La storica ed eloquente figura 6 è tratta dalla lezione Nobel di Libby e riporta misure della riduzione frazionaria del Carbonio-14 rispetto all’abbondanza isotopica naturale effettuate su campioni di età nota. L'asse dei tempi giunge sino a 5000 anni orsono, da paragonare ai 5730 anni del tempo di dimezzamento. Le misure sono state effettuate in due laboratori diversi.
Il punto indicato con “Bible” e situato in corrispondenza di 2000 anni si riferisce ai rotoli biblici di Qumran, di cui sopra.
Il paragone con la previsione data dalla legge temporale del decadimento (linea continua) fornisce una verifica della validità del metodo.
In sostanza, il Carbonio-14 fornisce una sorta di “cronometro” (letteralmente "misuratore di tempo", dal greco chrónos, χρόνος: tempo e métron, μέτρον: misura), che scatta al momento in cui cessa l'assorbimento di Carbonio. Non resta che leggerlo con una tecnica adatta.
Ritorneremo sulla figura 5 quando parleremo delle tecniche di "lettura del cronometro" e commenteremo il (basso) valore del conteggio per minuto ottenibile tramite la rivelazione degli elettroni emessi nei decadimenti beta - .
Metodologia pratica per la datazione con il Carbonio-14
L’ipotesi semplificativa dietro il discorso condotto sul principio della datazione con il Carbonio-14 è la costanza della sua concentrazione nell’atmosfera.
Questa ipotesi è vera nella misura in cui è costante il flusso di radiazione cosmica. Non è rigorosamente così: lo dimostra l’osservazione delle variazioni nell’attività del Sole, che è la principale sorgente della radiazione che colpisce la Terra. Il problema è risolto mediante una curva di calibrazione costruita misurando il rapporto isotopico in reperti la cui età possa essere nota in altro modo. Pur se nata con spirito diverso, la figura 6 fornisce un primo esempio di curva di calibrazione.
| ...................................................................................................................
Fig. 7. Un esempio di datazione con il Carbonio-14 - Immagine Wikipedia | ..... | ...................... La figura 7 mostra un esempio pratico per illustrare la metodologia di datazione con il Carbonio-14, tramite una curva di calibrazione. Le unità (BP e BC) usate per contenuto in Carbonio e tempo sono specifiche del metodo. La curva a campana di colore rosa mostra la distribuzione di probabilità del contenuto in Carbonio, risultante dalla sua misura con relativa incertezza. La banda azzurra mostra il valore previsto in funzione del tempo trascorso, frutto di una calibrazione basata su campioni di età nota. Il risultato, espresso nella consueta scala temporale, indica che con 87.2 % di probabilità il campione in esame può essere datato tra il 630 e l’821 d.C. |
Una famosa datazione con il Carbonio-14
Una famosa datazione è quella della “ Sacra Sindone ”, per rispondere alla domanda: il tessuto è temporalmente compatibile con l’essere stato sudario di Gesù Cristo? La datazione venne effettuata nel 1988 e indicò una sua origine medioevale, con ovvio seguito di dibattiti e di ipotesi su effetti che possano avere alterato il risultato.
Tecniche di lettura del cronometro
Pur se piccolissimo (come riferimento ricordate il valore dell’abbondanza isotopica naturale), il rapporto isotopico del Carbonio-14 è misurabile con grande sensibilità.
Secondo la tecnica tradizionale, anche la lettura del cronometro è basata sulla radioattività. Parlando in modo rispettoso ma irriverente, la sensibilità proviene dal fatto i nuclei di Carbonio-14 sono pochissimi ma "strillano", cioè emettono elettroni nel decadimento beta - (reazione 2 in figura 4). Il conteggio degli elettroni per unità di tempo mediante un opportuno “rivelatore” permette di determinare il contenuto di Carbonio-14 nel campione, da cui si può risalire al rapporto isotopico e quindi leggere il cronometro.
Un valore tipico del conteggio di elettroni per minuto è fornito nella figura 5 in basso. Noterete subito che esso è molto modesto, in particolare se paragonato al numero totale di nuclei di Carbonio-14 presente nel campione. In un grammo-atomo di Carbonio (12 grammi) è contenuto un numero di atomi di Carbonio-12 pari al Numero di Avogadro N A = 6 x 10 23 . Il numero di atomi di Carbonio-14 in 12 grammi è ottenuto moltiplicandolo per l'abbondanza isotopica (circa 10 -12 ) e risulta valere 6 x 10 11 , ossia 600 miliardi. La quasi totalità dei nuclei di Carbonio-14 non entra nella misura, sta a vedere impassibile e aspetta migliaia di anni prima di decidersi a decadere emettendo un elettrone.
Per rendersene conto quantitativamente, facciamo un conto approssimato della probabilità di decadimento di un singolo nucleo per minuto. Il suo ordine di grandezza è già dato dal rapporto tra 1 minuto e il doppio del tempo di dimezzamento (5730 anni) e risulta essere 10 -10 . Un calcolo completo richiede il ricorso alla legge esponenziale del decadimento di un insieme di nuclei in funzione del tempo (vedete Radioattività e decadimenti nucleari ) e fornisce una probabilità di decadimento di un singolo nucleo per minuto circa eguale 2 x 10 -10 . Il numero di nuclei di Carbonio-14 che decadono nel corso di una misura di ragionevole durata è quindi molto basso e giustifica il basso valore del conteggio di elettroni.
Se però si pensa che quello che si vuole leggere non è altro che il numero "totale" di atomi di Carbonio-14 superstiti dal tempo della morte biologica, sorge spontanea la domanda: ma questi non si possono contare direttamente?
In effetti, in Chimica la determinazione quantitativa degli elementi presenti in un campione può essere fatta tramite la "spettrometria di massa". Potete vederne una descrizione e una rappresentazione schematica sul testo online Chimica: concetti e modelli , citato tra i collegamenti.
Nella spettrometria di massa, gli atomi dei vari elementi chimici sono estratti dal campione, “ionizzati” (cioè privati di almeno un elettrone), accelerati tramite un campo elettrico e quindi immessi in un campo magnetico, che ne deflette le traiettorie. Il punto è che a parità di velocità tanto maggiore è la massa, tanto maggiore è una forma di "rigidità" (in sostanza per inerzia) presentata dalle traiettorie stesse e tanto minore ne è la deflessione. I diversi elementi chimici possono così essere fisicamente separati, in modo da poterne determinare il contenuto nel campione.
Tuttavia, l’ordinaria spettrometria di massa – frequentemente utilizzata dai chimici - non offre la risoluzione necessaria per separare e distinguere il Carbonio-14 dall’Azoto-14 (un suo "isobaro"), presente anch’esso in ogni organismo biologico e in proporzione talmente maggiore da offuscarlo.
Spettrometria di Massa con Acceleratore
Nella seconda metà degli anni ’70 il problema è stato risolto mediante la “ Accelerator Mass Spectrometry ” (AMS, in italiano “Spettrometria di Massa con Acceleratore”). Vi presenteremo nel seguito un’immagine di uno spettrometro di tale tipo.
Tramite un acceleratore elettrostatico di particelle, gli atomi ionizzati provenienti dai campioni da datare vengono accelerati a energie di qualche MeV (milioni di elettronVolt). Il problema della separazione del Carbonio-14 dall’Azoto-14 viene risolto drasticamente, tramite l'eliminazione della presenza di quest'ultimo: gli ioni immessi nell'acceleratore sono negativi (cioè con aggiunta di elettroni, invece di rimozione), sufficientemente stabili per il Carbonio-14 ma non per l’Azoto-14.
Gli ioni sono poi estratti dall’acceleratore e immessi in un campo magnetico per l'analisi spettrometrica. Si ottengono così misure del rapporto isotopico più sensibili e precise di quelle date dalla tecnica di lettura classica, basata sul decadimento beta - . Per approfondimenti, vedete i collegamenti dati in fine articolo.
La maggiore sensibiltà nella lettura del cronometro fornita da questa tecnica permette di estendere l’intervallo di tempo storico accessibile alla datazione di campioni organici tramite il Carbonio-14.
Inoltre essa è applicabile a qualsiasi isotopo di elemento chimico (in campioni organici o inorganici) che possa essere accelerato e separato, secondo le caratteristiche dello spettrometro disponibile.
Spettrometria di Massa con Acceleratore e sicurezza nucleare
Pur se fuori dal tema datazione, è interessante citare l’applicazione della Spettrometria di Massa con Acceleratore a problemi di sicurezza nucleare.
Come detto in Fissione nucleare: fenomeno fisico e energia , l’impiego di Uranio come combustibile in reattori nucleari richiede che l’Uranio naturale sia “arricchito” in Uranio-235. Questo processo lascia un residuo, detto Uranio “impoverito”, può essere utilizzato per altre applicazioni.
Ma è necessario assicurarsi che l’Uranio impoverito non provenga dal riprocessamento di combustibile nucleare già usato in un reattore, nel qual caso esso costituisce un pericoloso veicolo di prodotti di fissione. Lo può denunciare un alto contenuto di Uranio-236, che la Spettrometria di Massa con Acceleratore è in grado di evidenziare.
Un altro esempio riguarda la misura dei rapporti isotopici del Plutonio presente nell’ambiente, per il monitoraggio del rispetto dei trattati internazionali contro la proliferazione nucleare.
Intervallo temporale accessibile alla datazione
Il tempo trascorso può essere determinato purché non sia né troppo breve né troppo lungo rispetto al tempo di dimezzamento del radioisotopo. Infatti, nel primo caso la sua riduzione sarebbe troppo piccola per essere valutata, nel secondo caso sarebbe il numero di nuclei residui ad essere troppo piccolo per essere misurato con un’incertezza accettabile. Per la datazione di campioni organici con il Carbonio-14 (5730 anni), con le tecniche attuali si può coprire un intervallo di tempo storico approssimativamente tra 100 e 50.000 anni.
Per datazioni al di fuori di quest’intervallo o su campioni di natura diversa (organica o inorganica), è necessario ricorrere ad altri radioisotopi . La Spettrometria di Massa con Acceleratore offre anche il vantaggio di una generale applicabilità.
Cronometro a bomba
Al tempo della “guerra fredda” tra mondo occidentale e impero sovietico, fu condotto un terrificante programma di prove di ordigni nucleari nell’atmosfera, che sostanzialmente durò dagli anni '50 sino ai primi anni ’60. Fu solo con la caduta del “muro di Berlino” (nel 1989), che venne il tempo di un accordo formale per la loro sospensione tramite i cosiddetti Trattati START, menzionati in Fissione nucleare: fenomeno fisico e energia .
| .................................................................................................................
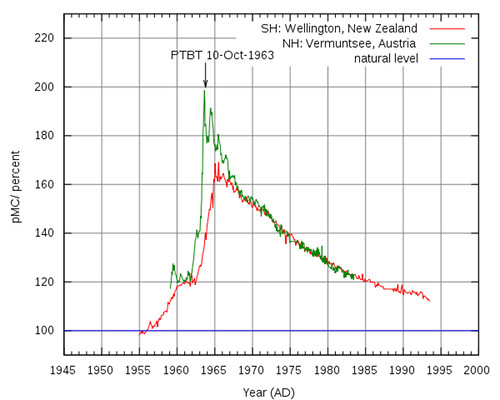
Fig. 8. Il picco di Carbonio-14 causato dalle esplosioni di bombe nucleari nell’atmosfera Immagine Wikipedia | ..... | ...................... I neutroni prodotti nelle esplosioni fecero temporaneamente quasi raddoppiare l’abbondanza isotopica del Carbonio-14 nell’atmosfera, come mostra il cosiddetto “ picco della bomba ” in figura 8, e quindi nella biosfera. La linea orizzontale blu in figura indica la normale abbondanza isotopica. Notate tuttavia che la scala verticale non inizia da zero. Le esplosioni avvennero predominantemente nell’emisfero Nord (grafico verde), per cui il picco nell’emisfero Sud (grafico rosso) risultò più piccolo e ritardato dal tempo di diffusione verso Sud. Con la fine delle esplosioni, l’eccesso di Carbonio-14 iniziò a decrescere con una velocità dovuta soprattutto ai modi di deposizione dall’atmosfera. Dopo circa una decina d’anni, l’eccesso risultò all'incirca dimezzato come si può vedere in figura. |
Il problema di mantenere la validità della datazione al Carbonio-14 tramite il classico “cronometro a decadimento nucleare” fu risolto facendo ricorso a una opportuna procedura di calibrazione tramite campioni non affetti dalle esplosioni.
Il picco della bomba fece scattare il “cronometro a bomba”, molto più rapido perché regolato dalla diminuzione del Carbonio-14 nell’atmosfera dopo il picco e quindi applicabile su tempi delle decine di anni. L’invenzione della “ datazione con il picco della bomba ” permise, ad esempio, la determinazione dell’anno di nsscita di un individuo tramite la determinazione del Carbonio-14 nello smalto dei denti. Il metodo è stato anche di aiuto in indagini per l’identificazione di cadaveri misteriosi.
In definitiva, quello che avrebbe potuto mettere in crisi una metodologia di misura inventata dagli scienziati sfruttando un fenomeno naturale è stato da loro sfruttato con un’altra invenzione: il cronometro a bomba. Irrefrenenabili nell’inventare!
...
Fig. 9. Willard Libby e il suo apparato per la datazione
Immagine UCLA History
Fig. 10. Lo Spettrometro di Massa con Acceleratore del Laboratorio LABEC a Firenze
Immagine M. Fedi – INFN/Firenze
Conclusione
La figura 9 mostra Willard Libby e il suo pionieristico apparato sperimentale, Oggi, la figura 10 ritrae uno Spettrometro di Massa con Acceleratore, quello del Laboratorio LABEC dell’INFN a Firenze. Un altro esempio è fornito dallo Spettrometro di Massa con Acceleratore del Laboratorio CIRCE a Caserta. La crescita di scala è impressionante, e corrisponde a un enorme progresso nella qualità delle misure e nel dominio di applicabilità della datazione.
Infatti, come si è detto, ora il Carbonio-14 permette datazioni in un intervallo di tempo storico tra 100 e 50.000 anni, molto più esteso di quello mostrato nella Curva dei Conosciuti in figura 6. Inoltre l'impiego di altri radioisotopi ha esteso la possibilità di datazione a campioni di natura diversa – anche inorganici, come rocce – e alle diverse scale di tempo permesse dal loro tempo di dimezzamento.
Fig. 11. Tramonto invernale all’ombra della quercia - Immagine Massimo su Nikonclub
Come quella della radiodatazione, importanti invenzioni possono nascere con apparecchiature modeste e portare poi a grandi sviluppi. E anche la grande quercia in figura 11 è cresciuta da un piccolo seme.
Collegamenti
G. Valitutti, M. Falasca, A. Tifi e A. Gentile, Chimica: concetti e modelli, ll numero di massa e gli isotopi , Ebook Zanichelli Scuola
Pier Andrea Mandò, Fisica nucleare per l’Arte e l’Archeologia , Asimmetrie/INFN 9 (2009) e Seminario
Mariaelena Fedi, La datazione al radiocarbonio per mezzo della Spettrometria di Massa con Acceleratore (2009)
Beta Analytic, Datazione al radiocarbonio con spettrometria di massa con acceleratore e Introduction to Radiocarbon Determination by the Accelerator Mass Spectrometry Method
Vincenzo Roca e Paolo Strolin
.
Professore Emerito di Fisica Sperimentale
Università di Napoli "Federico II"
Complesso Univ. Monte S. Angelo
Via Cintia - 80126 Napoli - Italy
Ultima Modifica 8 Anni 11 Mesi fa da Paolo.
Si prega Accesso a partecipare alla conversazione.
Tempo creazione pagina: 0.537 secondi